- پویا ویژن وارد کننده مواد اولیه غذایی
- 02144357890
- 09122368819
- info@pouyavizhen.com
سوربیتول ضد انقباض فریتوتانسفراز انولین ناشی از فشار هیدرواستاتیک است
سوربیتول ضد انقباض فریتوتانسفر
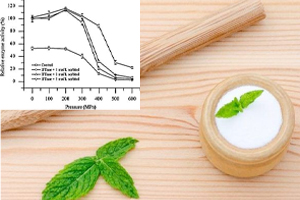
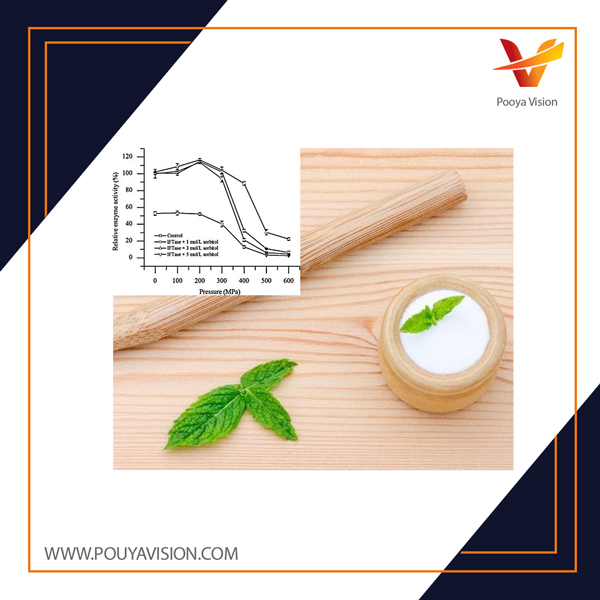
فروکتوتانسفراز اینولین (IFTase)، یک هیدرولاز جدید برای اینولین، در حضور یا عدم وجود سوربیتول در فشار ۴۰۰ و ۶۰۰ مگاپاسکال به مدت ۱۵ دقیقه در معرض فشار هیدرواستاتیک بالا (HHP) قرار گرفت. سوربیتول از آنزیم در برابر از دست دادن فعالیت ناشی از HHP محافظت می کند. فعالیت نسبی باقی مانده تقریباً ۳٫۱- و ۳٫۸ برابر در حضور ۳ مول/لیتر سوربیتول تحت ۴۰۰ مگاپاسکال و ۶۰۰ مگاپاسکال به مدت ۱۵ دقیقه افزایش یافت.

نتایج دوگانگی دایره ای نشان داد که ترکیب آشفته آنزیم تحت HHP به ترتیب منظم تر و تأثیر آن با ۳ مول/لیتر سوربیتول تغییر کرده است. نتایج فلورسانس و طیف ماوراء بنفش نشان می دهد که سوربیتول تا حدی از باز شدن آنزیم جلوگیری کرده و ترکیب را تحت فشار بالا تثبیت می کند. این نتایج ممکن است به اتصال سوربیتول در سطح IFTase نسبت داده شود و پیوندهای هیدروژنی درون و بین مولکولی را تقویت کند.
نمونه های زیادی در زمینه اعمال فشار هیدرواستاتیک بالا (HHP) برای تعدیل پایداری و فعالیت آنزیم ها وجود دارد. اثر دما، مشابه اثرات بی ثبات سازی بر آنزیم های ناشی از HHP مستقیماً با از دست دادن فعالیت مرتبط است. علاوه بر این، فشار هیدرواستاتیک بالا نیز برای افزایش فعالیت کاتالیزوری و پایداری حرارتی -کموتریپسین استفاده شده است. در این فرایند بیولوژیکی، HHP به عنوان یک ابزار جذاب و مهم می تواند تغییرات ساختاری آنزیم ها را آشکار کند.
سوربیتول ضد انقباض فریتوتانسفراز انولین ناشی از فشار هیدرواستاتیک است
این می تواند اطلاعات بسیار مفیدی مانند تداخل و بی ثباتی فعل و انفعالات برای این مولکولها را ارائه دهد. پروتئین ها یا آنزیم ها به طور کلی توسط درمان های HHP باز می شوند، که یک پدیده پیچیده به ساختار پروتئین، ترکیبات حلال و سایر عوامل محیطی بستگی دارد. HHP تأثیر زیادی بر باز شدن یا تجمع پروتئین ها یا آنزیم ها عمدتا با بازآرایی و/یا تخریب پیوندهای غیر هم ظرفیتی مانند برهم کنش های الکترواستاتیک و آبگریز، پیوندهای هیدروژنی و پیوندهای دی سولفیدی دارد که به طور معمول ساختار ثانویه و سوم را تثبیت می کند. بر اساس مکانیسم فوق، زمانی که این پیوندهای غیرکووالان تحت HHP تقویت شوند، می توان آنزیم را تثبیت کرد.
نتایج نشان میدهد که اسمولیت ها می توانند پیوندهای غیر هم ظرفیتی زیادی مانند پیوندهای هیدروژنی ایجاد کنند. آزمایشات متعدد نشان داده است که اسمولیت ها از جمله گلیسین بتائین، ترهالوز، سوربیتول، ساکارز، گلیسرول و سایر مواد آلی کوچک می توانند آنزیم ها یا پروتئین ها را در شرایط انجماد، میدان الکتریکی پالسی و تنش های حرارتی تثبیت کنند. افزودن این اسمولیت های با وزن مولکولی کم به محلول آبی پروتئین منجر به تغییر نامطلوب انرژی آزاد می شود که برای توضیح عملکرد تثبیت کننده پروتئین اسمولیت ها استفاده می شود. این نظریه حذف مواد املاح به عنوان مکانیزم محافظ اولیه برای اثرات تثبیت کننده اسمولیت ها بر پروتئین در برابر تنش های تغییر رنگ در نظر گرفته می شود. افزایش ثبات آنزیم ها در برابر خنثی سازی با فشار بالا اخیراً به نگرانی بزرگی برای انجام تبدیلات آنزیمی جدید در فشار بالا تبدیل شده است.
سوربیتول ضد انقباض
بحثث مطالعه حاضر نشان داد که سوربیتول می تواند از IFTase در برابر HHP محافظت کند و این حفاظت وابسته به دوز بود. بسیاری از تحقیقات همچنین اثرات سوربیتول را بر روی آنزیم های تحت درمان با HHP به طور طولانی مطالعه کرده اند، به عنوان مثال، ATPase ، -galactosidase و اینورتاز توسط سوربیتول در برابر غیرفعال سازی فشار تثبیت می شود. با این حال، هیچ مکانیزم معتبر جهانی برای حفاظت توسط سوربیتول وجود ندارد. مطابق با نظریه هیدراتاسیون، فعالیت آب محلول پیچیده پلیول-آنزیم به عنوان یکی از مهمترین تأثیرات بر تثبیت پروتئین در نظر گرفته می شود. همچنین نشان داده شده است که افزایش ویسکوزیته محلول پیچیده پلیول-آنزیم به تثبیت ساختاری کلاژن کمک می کند.
با این حال، افزایش بیشتر غلظت سوربیتول مانع فعالیت آنزیم می شود، اگرچه ویسکوزیته نیز افزایش می یابد و فعالیت آب کاهش می یابد. این نتایج نشان می دهد که ویسکوزیته و فعالیت آب تنها به عنوان نشانه ای از اثرات ارائه شده است، اما خود عامل تثبیت IFTase نیستند. چندین محقق گزارش داده اند که تغییر رنگ آنزیم های ناشی از HHP به طور کلی به فعل و انفعالات درون مولکولی و درون پروتئین ها بستگی دارد. بنابراین وقتی این تعاملات افزایش یافت، ممکن است پروتئین تثبیت شود. سوربیتول با گشتاور دو قطبی بالا می تواند باعث ایجاد اختلال در پیوندهای هیدروژنی داخلی گروه های آمینواسید شود که منجر به اختلال در ساختار پروتئین می شود.
این اثر الکل پلی هیدریک به عنوان یک نرم کننده باعث باز شدن پروتئین هایی مانند -لاکتوگلوبولین و -کازئین و انعکاس مجدد به شکل -حلقه ای می شود که به دلیل کاهش اثرات آبگریز ناشی از دی الکتریک پایین سوربیتول، پایدارترین شکل از نظر انرژی است. با این حال، سطوح بیش از حد سوربیتول ممکن است به دلیل وجود پیوند هیدروژنی ارائه شده، ترکیب بومی را از بین ببرد و منجر به غیر فعال شدن آنزیم تحت فشار محیط یا HHP شود. تشکیل پیوندهای هیدروژنی بین مولکولی جدید را می توان با پارامترهای هیدرودینامیکی و هیدرواستاتیک مانند ویسکوزیته محلول آنزیم سوربیتول منعکس کرد. با پیوندهای هیدروژنی بیشتر، ویسکوزیته محلول بیشتر است و آنزیم تا حدودی تثبیت می شود.

غشای سوربیتول
این می تواند نشان دهد که چرا فعالیت آنزیم با افزایش ویسکوزیته محلول در سطح مولکولی افزایش می یابد. بر اساس مکانیسم فوق، باز شدن ساختار پایدار تشکیل شده از IFTase نیاز به فشار بیشتری دارد تا پیوندهای هیدروژنی را مختل کند. بنابراین، در محدوده فشار خاصی، افزودن سوربیتول به محلول آنزیمی به تثبیت پروتئین کمک می کند و تا حدی فعالیت را نیز حفظ می کند. علاوه بر این، با توجه به نتایج آزمایش های فلورسانس، باقی مانده های تریپتوفان IFTase ممکن است در حضور ۳ مول/لیتر سوربیتول به طور کامل در معرض حلال قطبی قرار نگیرند.
بنابراین سوربیتول ممکن است تمام سطح پروتئین را بپوشاند و لایه هایی از “غشای سوربیتول” را تشکیل دهد، که ممکن است برهمکنش های آبگریز بین آمینو غیر قطبی را تقویت کند. اسیدهایی که به تثبیت ساختار سه بعدی آنزیم کمک می کند و ممکن است آب دوستی ناشی از تشکیل کمپلکس پروتئین-سوربیتول را به دلیل فعل و انفعالات مستقیم بین بقایای قطبی و سطح آنزیم افزایش دهد. همچنین نشان داده شده است که پلیول می تواند پیوند هیدروژنی را بین آب افزایش دهد و شبکه پیوند هیدروژنی را با سطح پروتئین تقویت کند.
نتیجه گیری
در این مقاله افزایش فعالیت IFTase در برابر HHP با ۳ مول/لیتر سوربیتول بیان شد. شواهد ارائه شده در این کار نشان می دهد که ترکیب IFTase پایدارتر و فشرده تر از ۴۰۰ یا ۶۰۰ مگاپاسکال بود هنگامی که سوربیتول با نتایج CD دور UV، فلورسانس و طیف UV اضافه شد. پیوندهای هیدروژنی ممکن است بین آنزیم و پلیول تقویت شده و در نتیجه ویسکوزیته محلول مخلوط افزایش یابد.