- پویا ویژن وارد کننده مواد اولیه غذایی
- 02144357890
- 09122368819
- info@pouyavizhen.com
مدلسازی غلظت اسید آسکوربیک
مدلسازی غلظت اسید آسکوربیک
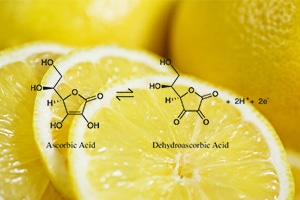
سینتیک تخریب ویتامین C (اسیدهای آسکوربیک و دهیدروآسکوربیک، AA و DHA) تحت شرایط کنترل شده دما (۵۰-۹۰ درجه سانتیگراد) و غلظت اکسیژن در فاز گاز (۱۰-۳۰٪ mol/mol) با استفاده از یک راکتور خاص تعیین شد. تخریب ویتامین C در بافر مالات (۲۰ میلیمولار، pH 3.8)، شبیهسازی پوره سیب، با نمونهبرداری در فواصل منظم و اندازهگیری طیفسنجی سطوح AA و DHA در ۲۴۳ نانومتر ارزیابی شد.
مدلسازی سینتیکی غلظت آسکوربیک اسید و دی هیدروآسکروبیک
نتایج نشان داد که تخریب AA با دما و غلظت اکسیژن افزایش مییابد، در حالی که DHA رفتار یک گونه میانی را نشان میدهد و ابتدا ظاهر و سپس ناپدید میشود. یک مدل جنبشی برای شبیهسازی دادههای تجربی با دو واکنش مرتبه اول متوالی با موفقیت توسعه داده شد. اولین مورد تجزیه AA را به عنوان تابعی از دما و غلظت در اکسیژن محلول نشان داد و دومی تجزیه DHA را فقط به عنوان تابعی از دما منعکس کرد، هر دو به اندازه کافی از قانون آرنیوس پیروی می کردند.

مدلسازی سینتیکی غلظت آسکوربیک اسید و دی هیدروآسکروبیک در یک راه حل مدل در دمای مختلف و محتوای
بیشتر میوهها و سبزیجات تازه حاوی سطوح بالایی از ویتامین C هستند که برای سلامت انسان اهمیت ویژهای دارند. ویتامین C بسیاری از عملکردهای بیولوژیکی تثبیت شده ای دارد که برای متابولیسم های آنزیمی و سلولی ضروری هستند. کمبود آن فعالیت چندین سیستم آنزیمی درگیر در سنتز کلاژن را کاهش می دهد و باعث ایجاد اسکوربوت می شود. ویتامین C به عنوان یک آنتی اکسیدان عمل می کند و نقش محافظتی بالقوه ای در برابر بیماری های قلبی عروقی و برخی سرطان ها دارد.
همچنین میتوان آن را به محصولات میوهای اضافه کرد تا سطح ویتامین آنها را تقویت کند و همچنین یک آنتی اکسیدان برای جلوگیری از قهوهای شدن آنزیمی یا اکسید شدن مواد مغذی یا طعمها. برای کاربردهای تغذیه ای، ویتامین C به مجموع اسید L-آسکوربیک (شکل کاهش یافته، که از این پس به عنوان AA نشان داده می شود) و اسید دهیدروآسکوربیک (شکل اکسید شده، از این پس به عنوان DHA نشان داده می شود) اشاره دارد.
سینتیک تخریب اسید اسکوربیک یک رفتار نمایی مطابق با یک واکنش مرتبه اول را نشان می دهد که به طور کلاسیک توضیح داده شده است. سینتیک اسید دهیدروآسکوربیک یک فاز افزایشی و به دنبال آن یک فاز کاهشی را نشان داد که مطابق با این بود که یک محصول میانی است که بهطور متوالی تشکیل و تخریب میشد. تکرارپذیری آزمایشها، که با مقایسه سه مجموعه از دادههای بهدستآمده در هر شرایط آزمایشی ارزیابی میشود، کاملاً رضایتبخش است.
با این حال، تغییر بین منحنی ها ممکن است به دلیل تفاوت در محتویات اولیه AA باشد که اندازه گیری آن به دلیل زمان مورد نیاز برای همگن سازی پس از افزودن محلول ذخیره حاوی AA در t = 0 غیرممکن بود. مقادیر باید اصلاح شوند. اسید اسکوربیک با هموارسازی نمایی داده های تجربی (مواد تکمیلی) شناسایی شد. پس از این مرحله استانداردسازی، همه سینتیک ها بین ۱ تا ۰ تغییر می کنند و سپس می توان همه آنها را با هم به عنوان تکرار در نظر گرفت. نتایج تکرارپذیری خوب را تأیید کرد زیرا انحرافات استاندارد برای اسید اسکوربیک (میانگین ضریب تغییرات ۱۶٪) بسیار کم بود، اما برای DHA (میانگین CV 47٪) به دلیل مقادیر کمتر اندازه گیری شده بیشتر بود.

بررسی در دماهای بالاتر
همانطور که انتظار می رفت، واکنش تخریب توسط دما افزایش یافت. تاثیر اکسیژن به محدوده دما بستگی دارد. به نظر می رسد افزایش فشار جزئی بر تجزیه AA در دماهای پایین (۵۰ و ۶۰ درجه سانتیگراد) تأثیری ندارد، اما در دماهای بالاتر (۷۰ تا ۹۰ درجه سانتیگراد) تأثیر قابل توجهی دارد که منجر به کاهش محتوای اسید اسکوربیک باقی مانده می شود. این رفتار متفاوت در مورد اکسیژن در مطالعات قبلی گزارش نشده است که در آن افزایش غلظت اکسیژن محلول باعث افزایش ثابت سرعت جنبشی حتی در دماهای پایین می شود. نتیجه گیری در مورد تأثیر دما و اکسیژن بر رفتار DHA در این مرحله به دلیل دو واکنش متوالی درگیر (تشکیل DHA از AA و تخریب DHA به محصولات بعدی) دشوار است، که هر دو به طور بالقوه به دما بستگی دارند.
نتیجهگیری
این کار اثرات دما و غلظت اکسیژن محلول را بر رفتار اسیدهای آسکوربیک و دهیدروآسکوربیک در یک محیط مایع نشان داد. تخریب آسکوربیک اسید مطابق با دما افزایش یافته است و می توان با موفقیت با استفاده از یک مدل جنبشی ظاهری مرتبه اول تحت تمام شرایط دما و اکسیژن مورد مطالعه توصیف کرد. به نظر می رسد که تخریب DHA به دما بستگی دارد اما نه به غلظت اکسیژن، همانطور که می توان با توجه به مسیر واکنش پیش بینی کرد، که به خوبی توسط یک واکنش مرتبه اول و ثابت های سرعت جنبشی شناسایی شده که به اندازه کافی از قانون آرنیوس پیروی می کنند، توصیف می شود.
با این حال، اگرچه این مدل ظاهری شبیهسازی خوبی از رفتار AA و DHA در طول زمان ایجاد کرد، اما برای توضیح وابستگی اکسیژن تخریب AA کافی نبود. در واقع، یک وابستگی مشخص از واکنش به محتوای اکسیژن محلول پیدا شد و این باید در مدل در نظر گرفته شود. به این ترتیب، یک ثابت سرعت جنبشی واقعی تر (k1) را می توان محاسبه کرد و نه تنها یک ثابت سرعت جنبشی ظاهری (kapp) وابسته به غلظت اکسیژن.
در رابطه با این k1، ضریب استوکیومتری اکسیژن (β) نیز باید شناسایی شود. با این حال، برخی از محدودیت ها در طول فرآیند شناسایی، با توجه به پارامترهای به شدت جفت شده مشاهده شد. تلاش های انجام شده برای غلبه بر این جفت با استفاده از رگرسیون درجه دوم برای β(T) توانست این مشکل را کاهش دهد اما به طور کامل آن را حل نکرد. مطالعات بیشتر اکنون نیاز به بررسی بهتر مسیرهای واکنش تخریب اسید آسکوربیک دارد تا مدل را با واکنشهای جدید غنی کند و مشخص کند که آیا امکان بهبود عملکرد مدل و امکان استفاده گستردهتر از آن وجود دارد یا خیر.